W skrócie
Materia składa się z substancji stanowiących czyste pierwiastki lub związki chemiczne różnych pierwiastków, a także z mieszanin różnych substancji.
Postać materii zależy od rodzaju substancji, temperatury i ciśnienia.
Substancje i mieszaniny
Materia składa się z pierwiastków chemicznych, które mogą występować samodzielnie, w związkach chemicznych lub w mieszaninach. Substancje to czyste pierwiastki chemiczne lub związki chemiczne, stanowiące jednorodne połączenia co najmniej dwóch różnych pierwiastków chemicznych. Połączenie różnych substancji stanowi mieszaninę. Powietrze stanowi mieszaninę m.in. azotu, tlenu, argonu, dwutlenku węgla, pary wodnej i innych substancji, które nie tworzą jednorodnych połączeń. Mimo to jest to mieszanina jednorodna, ponieważ nie da się gołym okiem rozróżnić poszczególnych składników. Podobnie stal to stop, czyli jednorodna mieszanina metalu (żelaza) i węgla. Połączenie tych pierwiastków nie jest jednak jednorodne, ponieważ oba pierwiastki tworzą różne struktury, z których jedne stanowią osnowy, a inne to występujące w tych osnowach ośrodki. W tych samych warunkach możliwe jest współistnienie danej materii w różnych fazach oddzielonych granicami międzyfazowymi.
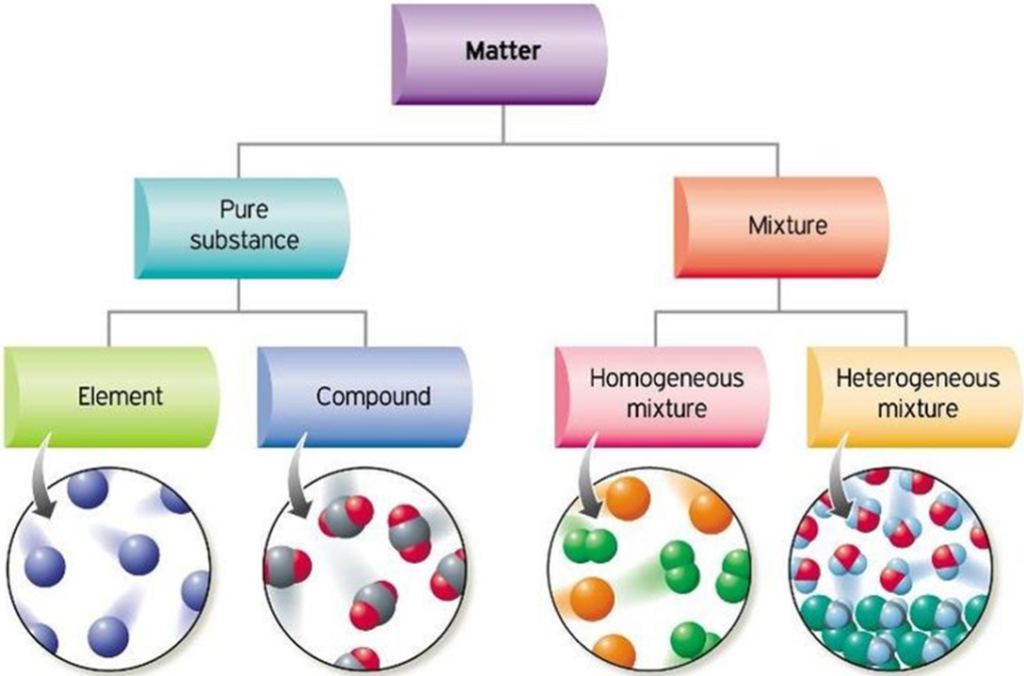
Podstawowe stany skupienia
Stany skupienia materii (fazy termodynamiczne) to podstawowe formy występowania substancji w zależności od parametrów stanu, takich jak temperatura i ciśnienie. Stan skupienia materii odzwierciedla sposób ułożenia oraz ruch i oddziaływania cząsteczek w danej substancji.
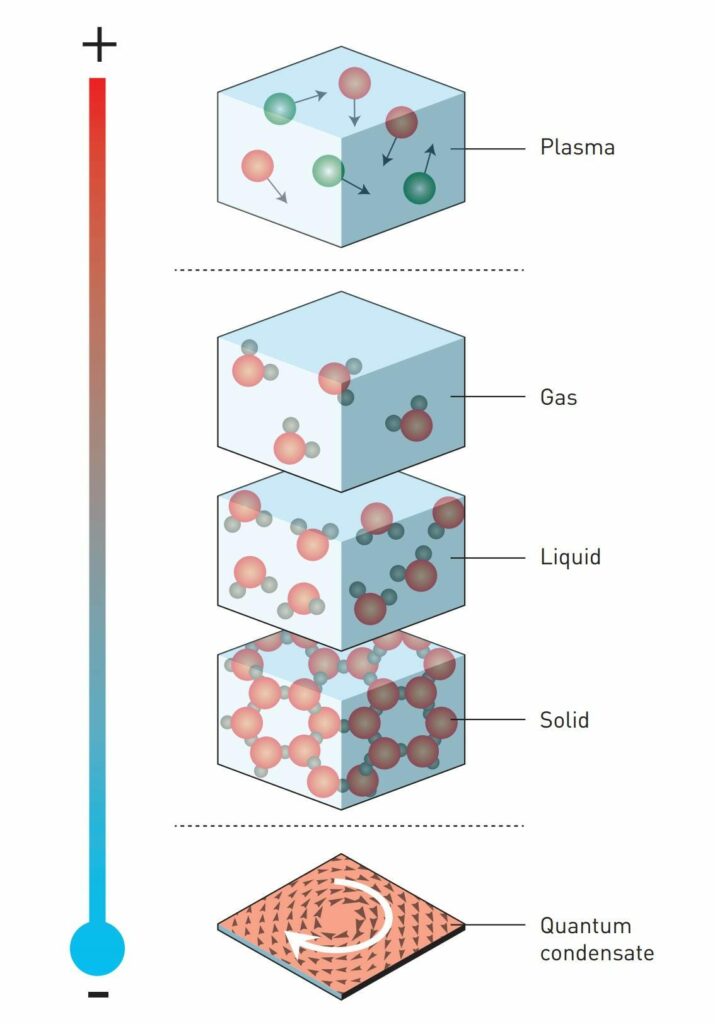
Najbardziej znane są trzy podstawowe stany skupienia: stan gazowy, ciekły i ciało stałe. Cząsteczki gazu są swobodne, a gaz zajmuje całą dostępną mu przestrzeń (łatwo zmienia objętość i kształt). Cząsteczki cieczy są ze sobą luźno powiązane, a ciecz w polu grawitacyjnym przybiera kształt naczynia, w którym się znajduje, ale nie dąży do tego, aby wypełnić całe naczynie (łatwo zmienia kształt, ale bardzo trudno zmienia objętość). Cząsteczki ciała stałego są ze sobą silnie powiązane, dlatego nie potrzeba naczynia, aby ciało stałe utrzymywało kształt i objętość (trudno je zmienić).
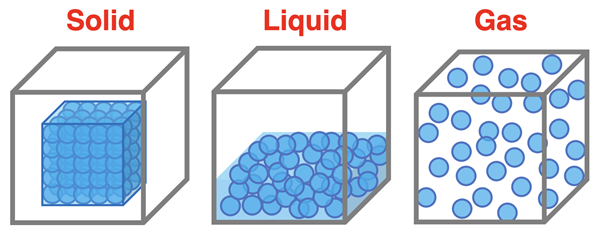
Przemiany fazowe
Przejście z jednego stanu skupienia materii do drugiego to przemiana fazowa. Przemiany fazowe zachodzą pod wpływem zmiany parametrów stanu tj. temperatury i ciśnienia materii. W warunkach normalnych (temperatura 0 st. C, ciśnienie 1013,25 hPa) ciekła woda zaczyna zamarzać, a lód zaczyna się topić (nie mylić z rozpuszczaniem). Poniżej temperatury krzepnięcia woda występuje w postaci stałej. Powyżej temperatury wrzenia (temperatura 100 st. C, ciśnienie 1013,25 hPa) woda zaczyna wrzeć, tj. parować całą swoją objętością, a para wodna zaczyna się skraplać, czyli kondensować. Powyżej temperatury wrzenia woda występuje tylko w postaci gazowej. W pewnych warunkach może zajść również bezpośrednia postaci stałej w gaz (sublimacja) lub w odwrotnym kierunku (resublimacja). W punkcie potrójnym wody (temperatura 0,01 st. C, ciśnienie ok. 611 Pa) woda może występować we wszystkich stanach skupienia jednocześnie w równowadze termodynamicznej.
Parametry stanu a substancje
Różne substancje w tych samych warunkach mogą znajdować się w różnych stanach skupienia. Na przykład w warunkach standardowych (temperatura 25 st. C, ciśnienie 1013,25 hPa) woda jest cieczą, powietrze jest mieszaniną gazów, a kamienie są ciałami stałymi. Gdyby obniżyć temperaturę (bez zmiany ciśnienia) do -20 st. C, ciekła woda zamarzłaby, stając się lodem, a powietrze nadal byłoby gazem, lecz gdyby obniżyć temperaturę do -200 st. C, również tlen i azot zawarty w powietrzu zacząłby krzepnąć. Zwiększenie temperatury powyżej 1000 st. C spowodowałoby, że niektóre kamienie zaczęłyby się topić, a w temperaturze 100 st. C woda przekształciłaby się w parę wodną, czyli gaz. Stan skupienia zależy też od ciśnienia. Spadek ciśnienia spowodowałby obniżenie temperatury wrzenia. W wysokich górach, gdzie mniej powietrza atmosferycznego wywiera ciśnienie na wodę, woda wrze w niższej temperaturze. Podwyższenie ciśnienia skutkowałoby tym, że trudniej byłoby zagotować wodę. Przykładowo z kominów hydrotermalnych na dnie oceanów wypływa gorąca woda, która z powodu wysokiego ciśnienia (stan nadkrytyczny) nie może wrzeć (punkt krytyczny wody: temperatura ok. 374 st. C, ciśnienie ok. 22 MPa).
Fazy
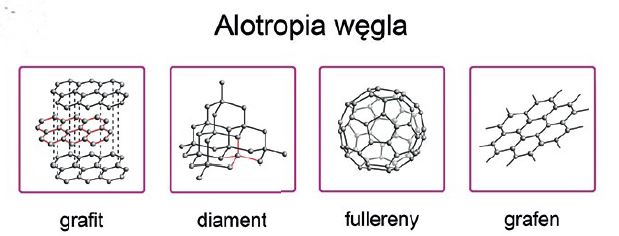
Pod wpływem zmian temperatury pierwiastki i mieszaniny mogą zmieniać fazy bez zmiany stanu skupienia. Czyste pierwiastki mogą występować w tym samym stanie skupienia w różnych odmianach alotropowych, na przykład pierwiastkowy węgiel może tworzyć struktury diamentu, grafitu, grafenu, fulerenu czy nanorurek. W mieszaninie faz fazy oprócz temperatury układu (przebiegu zmiany temperatur) są wypadkową stężeń, czyli proporcji jednych składników względem innych. Zjawiska te są wykorzystywane m.in. przy wytwarzaniu określonych gatunków stali o określonych właściwościach.
Struktury ciał stałych
Cząsteczki w ciałach stałych mogą mieć różny stopień uporządkowania. Sieć krystaliczna charakteryzuje się uporządkowanym ułożeniem atomów i cząsteczek, a sieć amorficzna ich nieuporządkowaniem, pomimo silnych wiązań. Cząsteczki w strukturze krystalicznej przyjmują określone pozycje i orientacje, tworząc symetryczne i przestrzennie powtarzalne układy. Strukturę krystaliczną mają kryształy soli kuchennej (kryształy jonowe), minerały takie jak kwarc i diament, czy metale, takie jak miedź. Ciało stałe może składać się z jednego kryształu (monokryształ) lub z wielu kryształów (polikryształ). Sieć amorficzna (bezpostaciowa) to struktura, w której cząsteczki są ze sobą powiązane, ale nie ma w nich uporządkowania. Przykładem ciała amorficznego jest szkło. Sieć strukturalna ciała stałego może również stanowić pewną uporządkowaną, ale nieregularną formę. Wówczas takie ciało to kwazikryształ (niby-kryształ).
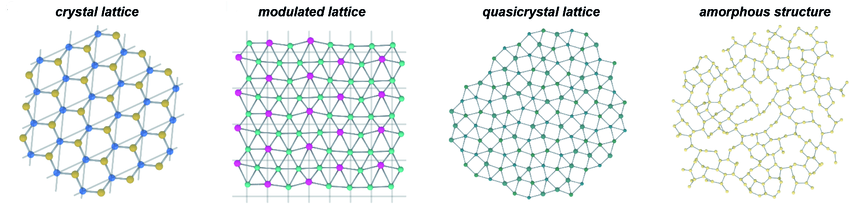
Pośrednie stany skupienia
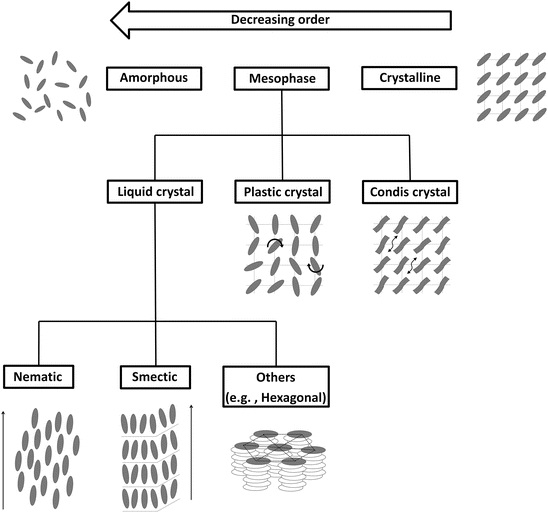
Poza trzema podstawowymi stanami skupienia wyróżnia się stany pośrednie. Stany pośrednie pomiędzy ciałem stałym a cieczą to ciekłe kryształy, kryształy plastyczne i kryształy condis. Ciekły kryształ to materia, która ma zdolność płynięcia (cecha cieczy – cząsteczki w obrębie objętości mogą się poruszać między sobą), ale cząsteczki zachowują dalekozasięgowe uporządkowanie (utrzymują pewien wzór i orientację). Ciekłe kryształy można przyrównać do napędu gąsienicowego, w którym człony gąsienicy są ze sobą połączone (uporządkowanie), ale zmieniają swoją pozycję względem innych elementów (ruchliwość) i nie są zdolne do utworzenia stabilnej struktury utrzymującej swój kształt (elastyczność). Istnieją różne rodzaje ciekłych kryształów. Cząsteczki w kryształach plastycznych mają zdolność zmiany orientacji (prawie swobodna rotacja dookoła miejsc równowagowych cząsteczek w obrębie swoich miejsc w sieci). Kryształ condis, to materia, której cząsteczki są długie i cienkie i formują równoległe względem siebie kolumny. Pod wpływem dużego ciśnienia substancja w tym stanie zaczyna płynąć, tak jak ciecz.
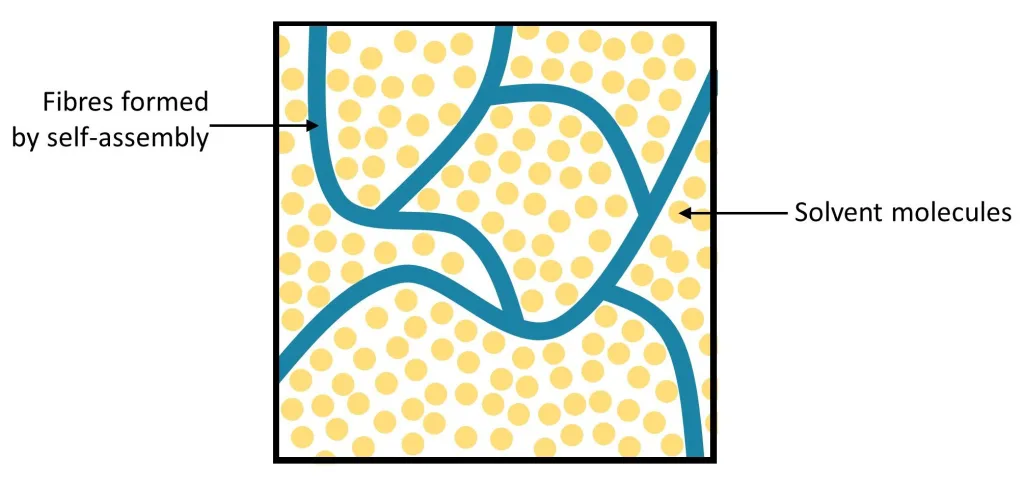
Na pograniczu ciała stałego i cieczy znajduje się również galaretka, która jest koloidem, czyli niejednorodną mieszaniną dwóch substancji. Jedna z tych substancji tworzy włóknistą strukturę sieciową, która więzi cząsteczki w fazie płynnej. Sieciowa struktura utrzymuje kształt galaretki (sprężystość kształtu), ale stosunkowo łatwo go zmienić pod wpływem większych sił (struktura łatwo się rozrywa).
Z kolei granica między cieczą a gazem znika w przypadku stanu nadkrytycznego (duże ciśnienie i temperatura, powyżej punktu krytycznego), czyli stanu pośredniego, w którym materia składa się z bardzo ruchliwych cząstek (bardzo ruchliwa ciecz lub bardzo gęsty gaz). Substancje w stanie nadkrytycznym mają zwiększoną dyfuzyjność, zmniejszoną lepkość i znikome napięcie powierzchniowe (cechy zbliżone do gazu), ale też dobrą zdolność do rozpuszczania (cecha zbliżona do cieczy).
Ciecze i gazy można zbiorczo określić jako płyny, ponieważ materia w tych postaciach potrafi płynąć, czyli łatwo zmieniać położenie jednych cząsteczek względem innych cząsteczek (ciała stałe nie mają takiej zdolności). Materiały sypkie, które składają się z wielu drobnych ciał stałych, mogą być czasem traktowane jak płyn (np. przy wysypywaniu).
Pozostałe podstawowe stany skupienia
Rozróżnia się też plazmę i kondensat Bosego-Einsteina jako czwarty i piąty stan skupienia. Plazma to zjonizowany gaz, w którym nad cząsteczkami ilościowo dominują cząstki, takie jak jony i elektrony. Dzięki takiemu składowi plazma w odróżnieniu od gazu potrafi przewodzić prąd elektryczny i jest wrażliwa na pole magnetyczne (cząsteczki gazu są obojętne elektrycznie). Przykładami plazmy są: płomień ognia, gaz w lampach neonowych i w kulach plazmowych pod działaniem prądu elektrycznego, wyładowania łuku elektrycznego, błyskawica podczas burzy, jonosfera w atmosferze ziemskiej, zorza polarna, wiatr słoneczny oraz gwiazdy włącznie ze Słońcem. Plazma najczęściej powstaje w wysokich temperaturach, a kondensat Bosego-Einsteina w bardzo niskich, bliskich zeru bezwzględnemu (-273,15 st. C). Im niższa temperatura, tym bardziej ujawnia się falowa natura korpuskularno-falowej materii. Kondensat Bosego-Einsteina to stan, w którym długość fali atomu wychodzi poza jego obręb, przez co oddziałuje z innymi atomami. Cząstki wówczas stają się nierozróżnialne (każdy atom zajmuje całą przestrzeń kondensatu, przez co nie da się zidentyfikować pojedynczego atomu) i zachowują się kolektywnie jako jedna fala materii.
Inne stany materii
Można wyróżnić również taki stan (skupienia?) materii, w którym cząstki atomowe są tak mocno ściskane, że protony i elektrony łączą się ze sobą, tworząc neutrony. Proces łączenia tych cząstek to neutronizacja materii i zachodzi podczas zapadania się masywnych gwiazd po wybuchu supernowej (ogromne ciśnienie). Po zwiększeniu ciśnienia neutrony mogą się rozpaść na cząstki elementarne, tworząc plazmę kwarkowo-gluonową.
Właściwości materii